Неогенетика: кто займется программированием живых организмов?
Чтобы расшифровать генную сеть, нужно найти взаимодействующие гены и выяснить характер (торможение или активация) и силу их связи. На основе полученной информации можно строить компьютерные вычислительные модели, которые просчитывают эти взаимодействия. Этим занимаются молекулярные биологи и биоинформатики. У расшифровки генных сетей есть два главных практических применения: медицинское и технологическое.
Ряд заболеваний (особенно "возрастных") происходит из-за разлада механизмов взаимодействия генов. Генные сети активно используют вирусы, когда проникают в клетку хозяина. Для поиска средств борьбы с этими напастями фармакологические компании проводят огромное число опытов с вероятными претендентами на роль эффективного лекарства. Обладая моделью происходящих внутри клетки процессов, подобные опыты можно проводить не на лабораторных животных, а при помощи компьютерного моделирования, что и дешевле и быстрее. Подобные модели позволяют искать как потенциальные мишени для лекарств, так и лекарственные вещества, воздействующие на них. Это обеспечивает интерес (выражающийся в финансировании) медицинских компаний к расшифровке генных сетей.
Другим возможными практическим применением генных сетей является "программирование" живых клеток на выполнение нужных нам функций. Это может быть синтез лекарственных веществ (антибиотики и не только), биотоплива, кормов для животных и не только.
Синтетическая биология
В последнее десятилетие зародилась и становится все более популярной синтетическая биология. На протяжении веков биологи изучали организмы, созданные природой в ходе эволюции. Идея синтетической биологии в том, чтобы самим проектировать живые системы с нужными свойствами. Это нужно не только для практических задач, но и для фундаментального познания природы. Ведь единственный способ действительно понять что-то - научиться делать, конструировать.
В синтетической биологии существуют два основных направления. Первое - создание простейших живых систем "с нуля". Второе - внедрение в живую клетку искусственных геномов или их участков. Разница примерно такая же, как между созданием компьютера и написанием для него программы. Первое - еще не удается, а вот второе - вполне.
Первым успехом по внедрению искусственной генной сети стало создание Майклом Еловицом (Michael Elowitz) и Станисласом Лайблером (Stanislas Leibler) "Репрессилятора" (Repressilator), который заставлял бактерий "мигать" наподобие новогодней гирлянды. Схема его простая: три гена, последовательно тормозящие друг друга, и еще один, который вырабатывает светящийся белок.
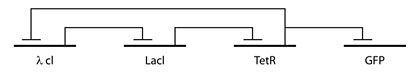
Ген GFP вырабатывает светящийся белок, а остальные входят в "часовой механизм"
Компьютерное моделирование показывало, что подобная схема должна привести к периодическим колебаниям в активности генов. Это же показали и живые бактерии, которым были внедрены (при помощи плазмид, небольших участков ДНК, которые самостоятельно встраиваются в геном бактерий) нужные гены. Что любопытно, несмотря на то, что генная сеть "Репрессилятора" была для каждой бактерии одинакова, вели они себя немного по разному: активность генов у них менялась с разным периодом, а у некоторых и вовсе не наблюдалось колебаний. Это объясняет, зачем для создания естественных "внутренних часов" (которые работают, к счастью, гораздо надежнее "Репрессилятора") эволюции потребовалось не три гена, а несколько десятков: дополнительные контуры отрицательных и положительных связей повышают надежность системы.
В январе прошлого года в Nature была опубликована статья, в которой авторы (Джефф Хэсти (Jeff Hasty) и его коллеги описали создание и внедрение генной сети, обеспечивающей не только колебание уровня флюоресцентного белка, но и обмен сигналами между отдельными клетками, позволявший выполнять синхронизацию свечения между ними.
Вначале они разработали вычислительную модель подобной сети и проверили ее работоспособность на компьютере. Затем, при помощи вирусов, они встроили живым бактериям нужные гены, позаимствованные из двух видов других бактерий (наподобие того, как собирался монстр Франкенштейна) и наблюдали за поведением клеток. Бактерии вели себя очень схожим с предсказанным образом, постепенно переходя в синхронный режим колебаний.
Создаются уже и применимые на практике разработки. Так биолог Дрю Энди (Drew Endy) из MIT занимается созданием биодетектора скрытых мин. В бактерии внедряется несколько взаимодействующих генов, которые кодируют белки-рецепторы (активизирующиеся тротилом) и сказанные с ними флюоресцентные белки. Затем микроорганизмы распыляются на местности. Там, где есть тротил в почве (а он неизбежно просачивается из мины наружу), бактерии синтезируют флуоресцентный белок, после чего в темное время суток мины можно обнаружить по свечению, которое испускается микробами.
Пусть меня научат
В России биоинформатикой занимаются в лабораториях Михаила Гельфанда (Институт проблем передачи информации) и Вадима Говоруна (Институт биоорганической химии). Находят там свое место люди различных специальностей: и биологи, и физики, и математики, и программисты.
Манолов Александр,
Институт Высшей Нервной Деятельности и Нейрофизиологии РАН,
аспирант / CNews
